A joint research team from Harvard Medical School (HMS) and MIT General Hospital says they have achieved tuning of the output of a microdisk laser using the PEC etching method, making a new source for nanophotonics and biomedicine “promising.”
(The output of the microdisk laser can be adjusted by the PEC etching method)
In the fields of nanophotonics and biomedicine, microdisk lasers and nanodisk lasers have become promising light sources and probes. In several applications such as on-chip photonic communication, on-chip bioimaging, biochemical sensing, and quantum photon information processing, they need to achieve laser output in determining wavelength and ultra-narrow band accuracy. However, it remains challenging to manufacture microdisk and nanodisk lasers of this precise wavelength on a large scale. Current nanofabrication processes introduce the randomness of disc diameter, which makes it difficult to obtain a set wavelength in laser mass processing and production.Now, a team of researchers from Harvard Medical School and Massachusetts General Hospital’s Wellman Center for Optoelectronic Medicine has developed an innovative optochemical (PEC) etching technique that helps to precisely tune the laser wavelength of a microdisk laser with subnanometer accuracy. The work is published in the journal Advanced Photonics.
Photochemical etching
According to reports, the team’s new method enables the manufacture of micro-disk lasers and nanodisk laser arrays with precise, predetermined emission wavelengths. The key to this breakthrough is the use of PEC etching, which provides an efficient and scalable way to fine-tune the wavelength of a microdisc laser. In the above results, the team successfully obtained indium Gallium arsenide phosphating microdisks covered with silica on the indium phosphide column structure. They then tuned the laser wavelength of these microdisks precisely to a determined value by performing photochemical etching in a diluted solution of sulfuric acid.
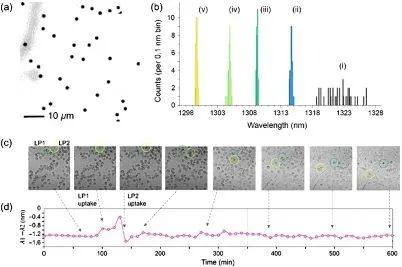
They also investigated the mechanisms and dynamics of specific photochemical (PEC) etchings. Finally, they transferred the wavelength-tuned microdisk array onto a polydimethylsiloxane substrate to produce independent, isolated laser particles with different laser wavelengths. The resulting microdisk shows an ultra-wideband bandwidth of laser emission, with the laser on the column less than 0.6 nm and the isolated particle less than 1.5 nm.
Opening the door to biomedical applications
This result opens the door to many new nanophotonics and biomedical applications. For example, stand-alone microdisk lasers can serve as physico-optical barcodes for heterogeneous biological samples, enabling the labeling of specific cell types and the targeting of specific molecules in multiplex analysis.Cell type-specific labeling is currently performed using conventional biomarkers, such as organic fluorophores, quantum dots, and fluorescent beads, which have wide emission linewidths. Thus, only a few specific cell types can be labeled at the same time. In contrast, the ultra-narrow band light emission of a microdisk laser will be able to identify more cell types at the same time.
The team tested and successfully demonstrated precisely tuned microdisk laser particles as biomarkers, using them to label cultured normal breast epithelial cells MCF10A. With their ultra-wideband emission, these lasers could potentially revolutionize biosensing, using proven biomedical and optical techniques such as cytodynamic imaging, flow cytometry, and multi-omics analysis. The technology based on PEC etching marks a major advance in microdisk lasers. The scalability of the method, as well as its subnanometer precision, opens up new possibilities for countless applications of lasers in nanophotonics and biomedical devices, as well as barcodes for specific cell populations and analytical molecules.
Post time: Jan-29-2024





